Vì Sao Ở Nhiệt Độ Thường Nito Khá Trơ Về Mặt Hoạt Động Hóa Học? Điều này sẽ được Huấn luyện an toàn lao động giải đáp trong bài viết sau đây. Mời bạn đọc cùng theo dõi!
Câu hỏi: Ở nhiệt độ thường nitơ khá trơ về mặt hoạt động hóa học là do
A. nitơ có bán kính nguyên tử nhỏ
B. phân tử nitơ không phân cực
C. nitơ có độ âm điện lớn nhất trong nhóm
D. phân tử nitơ có liên kết ba rất bền
Chọn đáp án D . Ở nhiệt độ thường, nitơ khá trơ về mặt hoạt động hóa học là do phân tử nitơ có liên kết ba rất bền
Giải thích:
N: 1s 2s 2p ⇒ Lớp ngoài cùng có 5e ⇒ Để hình thành phân tử nitơ thì mỗi nguyên tử nitơ đưa ra 3e để tạo ra 3 cặp e dùng chung với nguyên tử nitơ còn lại
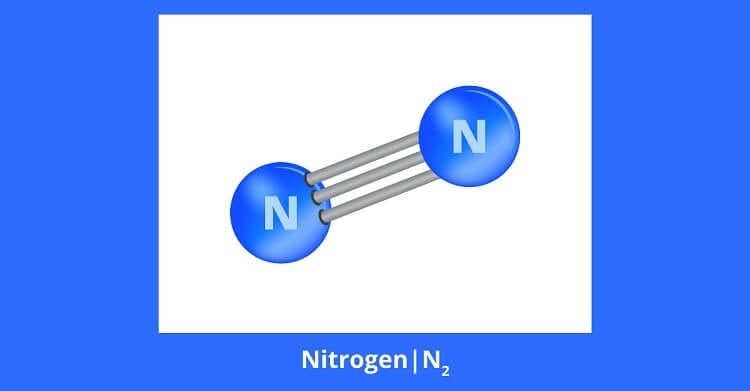
⇒ N≡N có liên kết 3 cực kỳ bền vững.
Trong phản ứng hóa học thì phải phá bỏ liên kết 3 này phản ứng mới xảy ra. Nhưng vì liên kết ba rất bền ⇒ nitơ khá trơ về mặt hóa học ở điều kiện thường.
Khái niệm nito là gì?
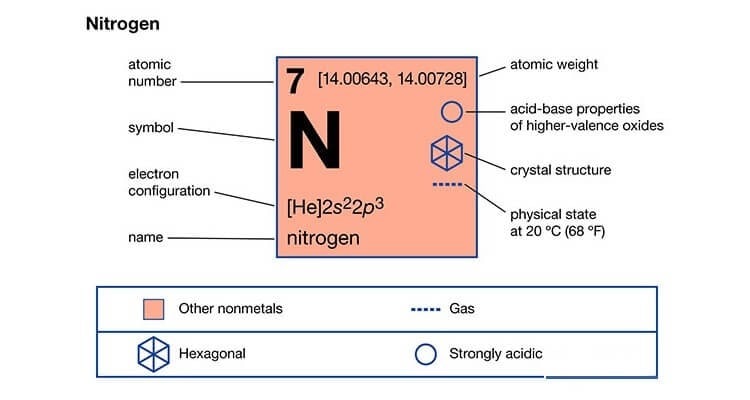
Nito là thành phần chính của khí quyển, góp phầ trong việc bảo vệ trái đất khỏi sự tác động, phá hủy của bức xạ mặt trời. Nito có công thức hóa học là N2
Khí nito chiếm khoảng 78 % và đay là thành phần của mọi cơ thể sự sống. Nito có hai dạng có tính ứng dụng cao đó là khí nito khí và nito lỏng. Trong đó nito lỏng được mọi người bắt gặp thường xuyên hơn bởi những đặc tính hữu ích của nó.
Lịch sử ra đời của nitơ
Nitơ (tiếng Latinh nitrum, tiếng Hy Lạp Nitron có nghĩa là “sự ra đời của soda”, “nguồn gốc”, “hình thức”) về hình thức được coi là được Daniel Rutherford phát hiện năm 1772, ông gọi nó là không khí độc hại hay không khí cố định. Đó là bởi vì phần không khí không hỗ trợ quá trình cháy đã được các nhà hóa học biết đến vào cuối thế kỷ 18.
Đồng thời, nitơ cũng được nghiên cứu bởi Carl Wilhelm Scheele, Henry Cavendish và Joseph Priestley, những người gọi nó là không khí bị cháy hoặc không khí phlogiston. Khí nitơ trơ đến mức Antoine Lavoisier vào năm 1789 coi nó là azode, nghĩa là không có sự sống. Thuật ngữ này trở thành tên tiếng Pháp của “nitơ” và sau đó lan sang nhiều ngôn ngữ khác. Năm 1790, Jean Antoine Chaptal đặt tên khí đó là nitơ.
Các hợp chất nitơ đã được biết đến từ thời trung cổ. Các nhà giả kim biết axit nitric (HNO3) là sức mạnh của nước. Hỗn hợp axit nitric và axit clohydric (HCl) được gọi là nước cường toan vì khả năng hòa tan vàng của nó.
Việc sử dụng các hợp chất nitơ trong công nghiệp và nông nghiệp sớm nhất là xanthate (có thể là natri nitrat (NaNO3) hoặc kali nitrat (KNO3)), chủ yếu làm thuốc súng, sau đó làm phân bón và sau đó để tạo ra các hóa chất bổ sung. Năm 1910, Lord Rayleigh phát hiện ra rằng sự phóng điện trong khí nitơ tạo ra “nitơ hoạt tính”, một dạng hình thù được gọi là đơn nguyên tử. Một “đám mây xoáy ánh sáng màu vàng sáng” được tạo ra bởi thiết bị của ông ấy phản ứng với thủy ngân để tạo ra thủy ngân nitride dễ nổ.
Tính chất vật lý
Khí Nitơ là chất khí không màu, không mùi, không vị. Nó có khối lượng nhẹ hơn không khí. Nitơ chiếm 4/5 trong không khí nhưng không có khả năng duy trì sự cháy và sự sống.
Nito ít tan trong nước. Những thông số đặc trưng gồm:
- Nhiệt độ hoá lỏng ở -196 độ C: Khí được ngưng tụ thành chất lỏng không màu, nhẹ hơn nước.
- Nhiệt độ hoá rắn cũng rất thấp ở -210 độ C
Tính chất hoá học
Nitơ là một hoạt chất ít tham gia các phản ứng hóa học, chỉ trong những điều kiện nhất định do phân tử chứa liên kết ba rất bền vững nên ở điều kiện thường. Nito vừa là chất khử vừa là chất oxi hoá.
Các mức oxi hoá mà nitơ có thể có là: -3, 0, +1, +2, +3, +4, +5. Nó có số oxi hóa 0 nên vừa thể hiện tính oxi hóa và tính khử.
– Tính oxi hoá
- Nitơ tác dụng với kim loại: Nitơ thể hiện tính oxi hóa khi tác dụng với nguyên tố có độ âm điện nhỏ hơn.
Trong điều kiện nhiệt độ thường, nitơ chỉ tác dụng với liti tạo liti nitrua: 6 Li + N2 → 2 Li3N
Trong điều kiện nhiệt độ cao, nitơ tác dụng với nhiều kim loại như 3 Mg + N2 → Mg3N2
Tuy nhiên, các nitrua dễ bị phân hủy tạo NH3
- Nitơ tác dụng với H2: Ở nhiệt độ cao, áp suất cao và có chất xúc tác. Nitơ phản ứng với hidro tạo ra amoniac.
– Tính khử (N2 + O2): Nitơ thể hiện tính khử khi tác dụng với nguyên tố có độ âm điện lớn hơn như oxy.
Phản ứng của nitơ với oxi xảy ra ở nhiệt độ 3000 độ C hoặc trong lò hồ quang điện: 2N + O2 → 2NO
Sau đó, nitơ monoxit tác dụng với oxi không khí tạo nitơ dioxit màu nâu đỏ: NO+1/2O2→NO2
Các oxit khác của nitơ là N2O, N2O3, N2O5 không điều chế trực tiếp được từ phản ứng giữa oxi và nitơ.
Trên đây là nhữn thông tin giải đáp Vì Sao Ở Nhiệt Độ Thường Nito Khá Trơ Về Mặt Hoạt Động Hóa Học. Huấn luyện an toàn lao động hi vọng bài viết này hữu ích với bạn!












![[GIẢI ĐÁP] Ma Túy Ketamin Là Gì Và Những…](https://huanluyenantoanlaodong.edu.vn/wp-content/uploads/2023/10/ma-tuy-ketamin-la-gi.html-2.jpg)
![[TÌM HIỂU] Niềng Răng Nên Kiêng Gì Và Những…](https://huanluyenantoanlaodong.edu.vn/wp-content/uploads/2023/09/nieng-rang-nen-kieng-gi.html-3-min.jpg)
![[TÌM HIỂU] Việc Tồn Tại Của Toàn Cầu Hóa…](https://huanluyenantoanlaodong.edu.vn/wp-content/uploads/2023/08/viec-ton-tai-cua-toan-cau-hoa-la.html-3-min.jpg)
![[TÌM HIỂU] Xesi Được Dùng Làm Tế Bào Quang…](https://huanluyenantoanlaodong.edu.vn/wp-content/uploads/2023/08/xesi-duoc-dung-lam-te-bao-quang-dien-1-min.jpg)
![[GIẢI ĐÁP] Vecto Gia Tốc Của Chất Điểm Có…](https://huanluyenantoanlaodong.edu.vn/wp-content/uploads/2023/08/vecto-gia-toc-cua-chat-diem-co-html-5-min.png)