Amoniac Có Làm Đổi Màu Quỳ Tím Không? Điều này sẽ được Huanluyenantoanlaodong giải đáp trong bài viết sau đây. Mời bạn đọc cùng theo dõi!

Amoniac Có Làm Đổi Màu Quỳ Tím Không ?
Quỳ tím là một chỉ thị hóa học được sử dụng để xác định tính axit hay bazơ của một dung dịch. Quỳ tím có màu tím ở pH trung tính, chuyển sang màu đỏ ở pH axit và chuyển sang màu xanh lá cây hoặc xanh dương ở pH bazơ.
Amoniac là một bazơ mạnh và có khả năng tương tác với các chất axit để tạo thành muối amoni. Khi amoniac hòa tan trong nước, nó sẽ phản ứng với nước để tạo thành ion amoni (NH4+) và ion hiđroxit (OH-). Phản ứng này có thể được biểu diễn bằng phương trình hóa học như sau:
NH3 + H2O ⇌ NH4+ + OH−
Do đó, dung dịch amoniac trong nước có tính bazơ và có pH cao hơn 7. Khi cho quỳ tím vào dung dịch này, quỳ tím sẽ chuyển sang màu xanh lá cây hoặc xanh dương, cho thấy dung dịch có tính bazơ.
Ngoài ra, khi tiếp xúc với khí amoniac, quỳ tím cũng sẽ chuyển sang màu xanh lá cây hoặc xanh dương. Điều này là do khí amoniac có thể kết hợp với hơi nước trong không khí để tạo thành dung dịch amoniac trong nước, và dung dịch này cũng có tính bazơ như đã trình bày ở trên. Vì vậy, khi giấy quỳ tím tiếp xúc với khí amoniac, giấy quỳ tím sẽ hấp thụ dung dịch amoniac trong nước và chuyển sang màu xanh lá cây hoặc xanh dương.
Amoniac là gì?
Amoniac là một hợp chất hóa học có công thức NH3, là một khí không màu, không mùi, có độc và có tính bazơ mạnh. Amoniac được sử dụng rộng rãi trong nhiều lĩnh vực khác nhau, như sản xuất phân bón, hóa chất, thuốc trừ sâu, sản phẩm tẩy rửa, chất khử trùng và chất làm mát. Amoniac cũng là một chất thải nitơ phổ biến của các sinh vật sống và góp phần vào nhu cầu dinh dưỡng của các sinh vật trên cạn.
Quỳ tím là một chỉ thị hóa học được sử dụng để xác định tính axit hay bazơ của một dung dịch. Quỳ tím có màu tím ở pH trung tính, chuyển sang màu đỏ ở pH axit và chuyển sang màu xanh lá cây hoặc xanh dương ở pH bazơ.
Cấu trúc của amoniac
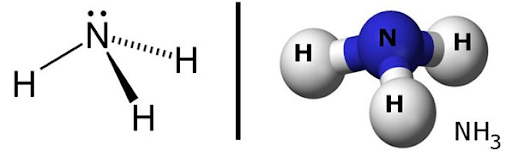
Amoniac là một phân tử ba phần tử gồm một nguyên tử nitơ (N) và ba nguyên tử hydro (H) được liên kết với nhau bằng liên kết cộng hóa trị. Cấu trúc của phân tử amoniac là hình học tứ diện với độ góc giữa các liên kết H-N-H là khoảng 107,5 độ.
Trong cấu trúc của phân tử amoniac, nguyên tử nitơ ở trung tâm là nguyên tử trung tâm không có điện tích. Các nguyên tử hydro được liên kết với nguyên tử nitơ thông qua liên kết cộng hóa trị đơn, điều này tạo thành một hình dạng tứ diện với nguyên tử nitơ là trung tâm của phân tử.
Bản chất của cấu trúc phân tử amoniac là tính bazơ mạnh và khả năng tạo liên kết hydro. Bên cạnh đó, do phân tử amoniac không phân cực, do đó, nó không có tính chất phân cực và không tan trong các dung môi phân cực như nước.
Tính chất của amoniac
Amoniac có nhiều tính chất vật lý và hóa học đặc biệt, sau đây là một số tính chất cơ bản của amoniac:
Tính chất vật lý của Amoniac
Dưới đây là một số tính chất vật lý cơ bản của amoniac:
- Trạng thái vật lý: Amoniac là một khí không màu, không mùi, có độc, có hương vị khắc, và có mật độ khí hơi cao hơn không khí. Amoniac tồn tại ở dạng khí ở điều kiện tiêu chuẩn (25 độ C, 1 atm).
- Điểm nóng chảy và điểm sôi: Điểm nóng chảy của amoniac là -77,73 độ C và điểm sôi là -33,34 độ C ở áp suất khí quyển bình thường.
- Độ tan: Amoniac không tan trong nước ngay lập tức, nhưng nó có thể hòa tan trong nước để tạo thành dung dịch amoniac.
- Tính bazơ: Amoniac là một axit yếu và một bazơ mạnh. Trong dung dịch nước, amoniac tạo thành ion amoni, tăng pH của dung dịch và có khả năng tương tác với các chất axit.
- Ngoài ra, amoniac có khả năng hòa tan các kim loại kiềm và hình thành các phức chất, tạo thành một số hợp chất có tính chất phức tạp và đa dạng
Tính chất hóa học
Tính bazơ: Amoniac là một bazơ mạnh và có khả năng tương tác với các chất axit để tạo thành muối amoni. Ví dụ, khi trộn amoniac với axit clohidric (HCl), sẽ tạo thành muối cloua amoni (NH4Cl).
Tính oxi hóa: Amoniac có thể được oxi hóa thành nitơ oxit (NO) hoặc nitơ đioxit (NO2) bởi các chất oxi hóa như oxi hoá nóng, oxi hoá phần tử halogen, hay oxi hoá bởi nguyên tử oxy có hoạt tính cao.
Điều Chế
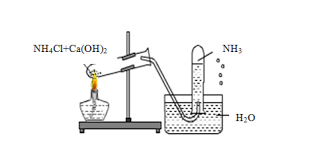
- Trong phòng thí nghiệm
NH3 – amoniac được điều chế bằng cách cho muối amoniac tác dụng với chất kiềm khi đun nóng nhẹ. Người ta cũng có thể đun nóng dung dịch amoniac đặc để cho ra nhanh một lượng nhỏ khí amoniac.
- Trong công nghiệp
Trong công nghiệp, Amoniac – NH3 được tổng hợp từ khí N2 và khí H2 theo phản ứng sau:
Công thức hóa học: N2 (k) + 3H2(k) ⇔ 2NH3 (k); ∆H = -92 kJ
Ứng dụng của amoniac

Amoniac có nhiều ứng dụng trong các lĩnh vực khác nhau, sau đây là một số ứng dụng chính của amoniac:
- Sản xuất phân bón:
Amoniac là nguyên liệu quan trọng để sản xuất các loại phân bón nitơ như urê, nitrat amoni, sulfat amoni và photphat amoni. Các phân bón này cung cấp nitơ cho cây trồng và cải thiện năng suất nông nghiệp.
- Sản xuất hóa chất:
Amoniac được sử dụng để sản xuất nhiều loại hóa chất khác như axit nitric, hydrazin, amin, cyanua và các chất nổ.
- Sản xuất thuốc trừ sâu:
Amoniac được sử dụng để sản xuất các loại thuốc trừ sâu như carbamat, organophosphat và neonicotinoid. Các thuốc trừ sâu này giúp bảo vệ cây trồng khỏi các loại sâu bệnh và cỏ dại.
- Sản xuất sản phẩm tẩy rửa:
Amoniac được sử dụng để sản xuất các loại sản phẩm tẩy rửa như nước rửa bát đĩa, nước lau kính, nước lau sàn và chất tẩy rửa vải. Các sản phẩm này giúp làm sạch và khử mùi các bề mặt và vật dụng.
- Sản xuất chất khử trùng:
Amoniac được sử dụng để sản xuất các loại chất khử trùng như cloramin và quaternary ammonium. Các chất này giúp diệt khuẩn và vi khuẩn gây bệnh trên các bề mặt và vật dụng.
- Sản xuất chất làm mát:
Amoniac được sử dụng làm chất làm lạnh trong các hệ thống lạnh công nghiệp và gia dụng. Amoniac có hiệu suất làm lạnh cao, chi phí thấp và thân thiện với môi trường.
Amoniac có kết tủa không?
Amoniac là một chất khí, do đó nó không thể tạo thành kết tủa trong điều kiện thông thường. Tuy nhiên, khi amoniac được hòa tan trong nước để tạo thành dung dịch amoniac, dung dịch này có thể tạo ra các kết tủa khi được trộn lẫn với các dung dịch chứa các ion kim loại như Ag+, Cu2+, Fe3+, và Mg2+.
Khi các ion kim loại này tương tác với ion amoni trong dung dịch amoniac, chúng sẽ tạo thành các muối kết tủa có màu sắc và tính chất khác nhau.
Ví dụ, khi dung dịch amoniac được trộn với dung dịch nitrat bạc (AgNO3), các ion amoni trong dung dịch sẽ tương tác với ion bạc (Ag+) trong dung dịch nitrat bạc để tạo thành kết tủa bạc amoni (AgNH3)2+, có màu trắng và rất khó tan trong nước.
Amoniac có tan không?
Amoniac (NH3) có khả năng tan trong nước và hòa tan tốt trong các dung môi có tính lưỡng cực như etanol và axeton. Tuy nhiên, độ tan của amoniac trong nước phụ thuộc vào nhiều yếu tố như nhiệt độ, áp suất và độ tinh khiết của dung dịch. Ở điều kiện tiêu chuẩn (nhiệt độ 25 độ C và áp suất khí quyển), độ tan của amoniac trong nước khoảng 57 g/L.
Đáng chú ý là khi hòa tan amoniac trong nước, nó tạo thành dung dịch amoniac có tính bazơ mạnh và có thể gây nguy hiểm nếu không được sử dụng đúng cách. Khi tiếp xúc với da hoặc mắt, dung dịch amoniac có thể gây đau rát, kích ứng và gây hại cho sức khỏe. Do đó, khi sử dụng amoniac và dung dịch amoniac cần tuân thủ các quy định an toàn và sử dụng đúng cách.
Trong bài viết này, chúng ta đã tìm hiểu về cấu trúc, tính chất và ứng dụng của amoniac, giải đáp Amoniac Có Làm Đổi Màu Quỳ Tím Không?. Huanluyenantoanlaodong hy vọng bài viết này đã cung cấp cho bạn những thông tin bổ ích và thú vị về amoniac và quỳ tím.












![[GIẢI ĐÁP] Ma Túy Ketamin Là Gì Và Những…](https://huanluyenantoanlaodong.edu.vn/wp-content/uploads/2023/10/ma-tuy-ketamin-la-gi.html-2.jpg)
![[TÌM HIỂU] Niềng Răng Nên Kiêng Gì Và Những…](https://huanluyenantoanlaodong.edu.vn/wp-content/uploads/2023/09/nieng-rang-nen-kieng-gi.html-3-min.jpg)
![[TÌM HIỂU] Việc Tồn Tại Của Toàn Cầu Hóa…](https://huanluyenantoanlaodong.edu.vn/wp-content/uploads/2023/08/viec-ton-tai-cua-toan-cau-hoa-la.html-3-min.jpg)
![[TÌM HIỂU] Xesi Được Dùng Làm Tế Bào Quang…](https://huanluyenantoanlaodong.edu.vn/wp-content/uploads/2023/08/xesi-duoc-dung-lam-te-bao-quang-dien-1-min.jpg)
![[GIẢI ĐÁP] Vecto Gia Tốc Của Chất Điểm Có…](https://huanluyenantoanlaodong.edu.vn/wp-content/uploads/2023/08/vecto-gia-toc-cua-chat-diem-co-html-5-min.png)