Phản ứng nhiệt phân là phản ứng hóa học xảy ra khi một chất bị phân huỷ thành các chất khác do tác dụng của nhiệt. Phản ứng nhiệt phân thường xảy ra với các chất hữu cơ, các muối nitrat, cacbonat, sulfat, clorat và perclorat.
Trong bài viết này, hãy cùng Huanluyenantoanlaodong tìm hiểu về Sản Phẩm Của Phản Ứng Nhiệt Phân Cuno32 Là gì?
Phương trình phản ứng nhiệt phân Cu(NO3)2- Sản Phẩm Của Phản Ứng Nhiệt Phân Cuno32 Là Gì?
Khi nhiệt phân muối Cu(NO3)2, ta thu được các sản phẩm là oxit đồng (II) (CuO), khí nitơ đioxit (NO2) và khí oxi (O2). Phương trình phản ứng nhiệt phân Cu(NO3)2 có dạng:
2Cu(NO3)2 => 2CuO + 4NO2 + O2↑
Điều kiện để phản ứng nhiệt phân Cu(NO3)2 xảy ra là nhiệt độ cao.
Nhiệt độ cần thiết để nhiệt phân Cu(NO3)2 là khoảng 170°C.
Cơ chế và tính chất của phản ứng nhiệt phân Cu(NO3)2

Phản ứng nhiệt phân Cu(NO3)2 là một ví dụ của nhóm phản ứng nhiệt phân muối nitrat của các kim loại từ magiê (Mg) đến đồng (Cu). Nhóm này bao gồm các kim loại có hoạt tính trung bình, không quá mạnh như nhóm trước Mg, cũng không quá yếu như nhóm sau Cu.
Khi nhiệt phân, các muối nitrat này bị phân huỷ thành oxit kim loại tương ứng, khí nitơ đioxit và khí oxi. Cơ chế của phản ứng có thể giải thích như sau:
- Khi đun nóng, muối nitrat bị tách thành ion kim loại và ion nitrat: Cu(NO3)2→Cu2++2NO3−
- Ion nitrat bị giải phóng điện tử và tạo thành khí nitơ đioxit và khí oxi: NO3−→NO2+21O2↑+e−
- Ion kim loại nhận điện tử và tạo thành oxit kim loại: Cu2++2e−→CuO
Tính chất của các sản phẩm thu được trong phản ứng nhiệt phân Cu(NO3)2 như sau:
- Oxit đồng (II) (CuO) là một chất rắn màu đen, không tan trong nước, có tính bazơ yếu. Oxit đồng (II) có thể tác dụng với axit mạnh để tạo thành muối đồng (II) và nước. Ví dụ: CuO+2HCl→CuCl2+H2O
- Khí nitơ đioxit (NO2) là một chất khí màu nâu đỏ, có mùi khai, có tính oxi hóa mạnh. Khí nitơ đioxit có thể tác dụng với nước để tạo thành axit nitric (HNO3) và axit nitơ (III) (HNO2). Ví dụ: 3NO2+H2O→2HNO3+HNO2
- Khí oxi (O2) là một chất khí không màu, không mùi, không vị, có tính cháy. Khí oxi có thể tác dụng với các chất khác để tạo thành các oxit. Ví dụ: O2+2H2→2H2O
Thông tin về Đồng nitrat Cu(NO3)2

Đồng (II) nitrat là một hợp chất vô cơ có bề ngoài là một chất rắn tinh thể màu xanh da trời.Muối khan của chất này tạo thành các tinh thể xanh lá cây-xanh da trời.
Tính chất vật lí : Là chất rắn, có màu xanh da trời. Thăng hoa trong chân không ở nhiệt độ 150-200 độC.
Tính chất hóa học: Có tính chất hóa học của muối.
Cu(NO3)2 + 2KOH → Cu(OH)2 + 2KCl
Cu(NO3)2 + Ba(OH)2 → Cu(OH)2 + Ba(NO3)2
Điều chế Đồng nitrat Cu(NO3)2
Cho kim loại đồng tác dụng với dung dịch HNO3
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO +4H2O
Cấu trúc hóa học Đồng nitrat Cu(NO3)2
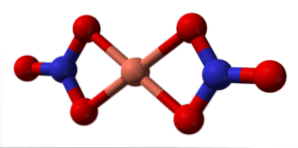
Một phân tử Cu (NO) bị cô lập được thể hiện trong hình trên trong pha khí. Các nguyên tử oxy của anion nitrat phối hợp trực tiếp với trung tâm đồng (quả cầu phối hợp bên trong), tạo thành bốn liên kết Cu-O.
Nó có một hình học phân tử phẳng vuông. Mặt phẳng được vẽ bởi các quả cầu đỏ ở các đỉnh và quả cầu đồng ở tâm. Tương tác pha khí rất yếu do lực đẩy tĩnh điện giữa các nhóm NO3–.
Tuy nhiên, trong pha rắn, các trung tâm đồng tạo thành liên kết kim loại -Cu-Cu-, tạo ra chuỗi đồng polymer.
Phân tử nước có thể hình thành liên kết hydro với các nhóm NO3–, và những thứ này sẽ cung cấp cầu hydro cho các phân tử nước khác, và cứ thế cho đến khi tạo ra một quả cầu nước xung quanh Cu (NO3)2.
Trong quả cầu này, nó có thể có từ 1 đến 6 hàng xóm bên ngoài; do đó muối dễ dàng được hydrat hóa để tạo ra muối tri và hexa ngậm nước.
Muối được hình thành từ ion Cu2+ và hai ion KHÔNG3–, tạo cho nó một tinh thể đặc trưng của các hợp chất ion (orthorhombic cho muối khan, rhomboh thờ cho muối ngậm nước). Tuy nhiên, các liên kết là cộng hóa trị nhiều hơn.
Công dụng Đồng nitrat Cu(NO3)2

Đối với màu sắc hấp dẫn của đồng nitrat, muối này được sử dụng làm phụ gia trong gốm sứ, trên bề mặt kim loại, trong một số pháo hoa và cả trong ngành dệt như một chất gắn màu.
Nó là một nguồn đồng ion tốt cho nhiều phản ứng, đặc biệt là những phản ứng xúc tác hữu cơ. Nó cũng tìm thấy việc sử dụng tương tự như các nitrat khác, như là thuốc diệt nấm, thuốc diệt cỏ hoặc làm chất bảo quản gỗ..
Một ứng dụng chính và sáng tạo nhất của nó là tổng hợp các chất xúc tác CuO, hoặc các vật liệu có phẩm chất nhạy sáng.

Nó cũng được sử dụng như một thuốc thử cổ điển trong các phòng thí nghiệm giảng dạy để hiển thị các phản ứng bên trong các tế bào bay hơi.
Rủi ro từ Đồng nitrat Cu(NO3)2
– Nó là một tác nhân oxy hóa mạnh, có hại cho hệ sinh thái biển, gây kích ứng, độc hại và ăn mòn. Điều quan trọng là tránh mọi tiếp xúc vật lý trực tiếp với thuốc thử.
– Nó không dễ cháy.
– Nó phân hủy ở nhiệt độ cao giải phóng các khí kích thích
– Trong cơ thể con người có thể gây ra tổn thương mãn tính cho hệ thống thần kinh tim mạch và trung ương.
– Có thể gây kích ứng ở đường tiêu hóa.
– Là một nitrat, bên trong cơ thể trở thành nitrite. Nitrite tàn phá nồng độ oxy trong máu và trong hệ thống tim mạch.
Trong bài viết này, chúng ta đã tìm hiểu về Sản Phẩm Của Phản Ứng Nhiệt Phân CuNO32 Là Gì? bao gồm phương trình, cơ chế, tính chất và sản phẩm của phản ứng. Huanluyenantoanlaodong hy vọng bài viết này sẽ giúp bạn hiểu rõ hơn về phản ứng nhiệt phân Cu(NO3)2 và các khía cạnh liên quan.